
Reinhold Fussinger, Kristina Fussinger
.
Клинические и гистологические результаты использования B -трикальцийфосфата при выполнении имплантации.
Рис.1. Аппликация RTR-B-TCP при выполнения синуслифтинга
В данной исследовательской работе оценивалась эффективность применения гранул B-трикальцийфосфат (B-TCP) для костной регенерации. Для оценки применялись гистологические методы. В течение 6 лет у 28 пациентов было проведено 40 операций синуслифтинга и у 26 пациентов - 22 наращивание гребня альвеолярного отростка. 72 пациентам было установлено 40 имплантатов. У 17 пациентов во время установки имплантантов были взяты образцы кости из той области, где ранее применялся B-трикальцийфосфат. Гистологические исследования доказали полную резорбцию гранул и замещение их костной тканью. Оптимальный период для установки имплантата наступает через 4,5 месяца после применения RTR. При установке имплантатов на верхнюю челюсть, где при синуслифтинге использовался RTR, эффективность составила 94,44 %. В группе, где имплантанты устанавливались после наращивания альвеолярного гребня, эффективность была еще выше и составила 100%.
Для стоматолога, занимающегося имплантологией, челюстно-лицевой и пластической хирургией, восстановление утраченной кости является чрезвычайно важной задачей.
Наряду с аутотрансплантацией, для регенерации костных дефектов применяется широкий спектр различных материалов - костных заменителей (1,2). Большое количество новинок, появляющихся на рынке, часто ставит врача в затруднительное положение (3). Поэтому, при выборе остеопластического материала, всегда следует основываться на данные клинических и научных исследований и учитывать биологические свойства материала.
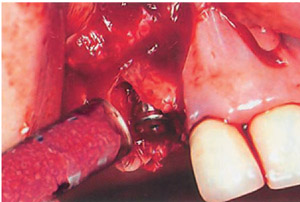 Рис. 2. применение RTR-B-ТСР при периимплантите.
Рис. 2. применение RTR-B-ТСР при периимплантите.С 1998 года мы используем в своей практике синтетический материал для костной регенерации: B-трикальцийфосфат (B-ТСР). Это - один из наиболее распространенных остеопластических материалов, который применяется в общей медицине уже более тридцати лет (4-6).
В стоматологической хирургии B-ТСР начал применяться с 1975 года для лечения пародонтальных костных дефектов (7). Его применение достаточно подробно описано в литературе (8-10). Материал характеризуется хорошей биосовместимостью и является высокоактивным остеоиндуктором (11-13). Многочисленные гистологические и лабораторные исследования на животных показали его полную резорбцию и замещение костной тканью (14-16).
Материалы и методы
 Рис. 3. RTR шприц с гранулами B-трикальцифасфата пропитанными кровью.
Рис. 3. RTR шприц с гранулами B-трикальцифасфата пропитанными кровью. В период с 1998 по 2003 гг. у 28 пациентов было проведено 3 одномоментных, у 37 - двухэтапных синуслифтинга, а у 26 пациентов - наращивания гребня альвеолярного отростка, из них - 22 с одномоментной имплантацией. Средний возраст пациентов при проведении синуслифтинга составлял 57 лет (54% мужчин и 46% женщин), при проведении наращивания гребня альвеолярного отростка - 48 лет (65% мужчин и 35% женщин).
В качестве материала для костной регенерации применялся резорбируемый пористый ? -трикальцийфосфат в гранулах. Аутокость не использовалась. Перед внесением в дефект, гранулы смешивались с кровью пациента.
Пропитывание кровью при применении RTR-B-TCP (Septodont) происходит непосредственно в шприце, в который упакован материал (Рис.3). При смешивании крови и гранул B- трикальцифасфата образуется смесь пастообразной консистенции, которая легко может быть наложена непосредственно в дефект. (Рис. 1 и 2). Материал вносится свободно и не уплотняется.
В некоторых случаях к смеси крови и гранул дополнительно добавлялся концентрат тромбоцитарной массы пациента для достижения лучшей регенерации. При проведении одного синуслифтинга в среднем требовалось 2,5 кв.см. вещества в
гранулах, а при наращивании гребня альвеолярного отростка - 0,6 кв.см вещества в гранулах. По объему это соответствует трем и одному шприцу RTR соответственно. Время до выполнения этапа имплантации составляло 6 месяцев. В основном использовались имплантаты Straumann (Freiburg) длиной 12, 14 и 16 мм, а в приращенную область - имплантанты длиной 10, 12 и 16 мм. При выполнении имплантации в 17 случаях с помощью трепанационного сверла (Hu-Friedy,) был произведен забор костного материала для выполнения гистологического исследования.
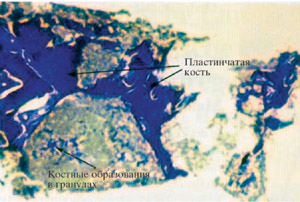 Рис. 4: Гистология через 4 месяцев синуслифтинга.
Рис. 4: Гистология через 4 месяцев синуслифтинга.
Надписи на рисунке: Костные образования в гранулах. Пластинчатые кости
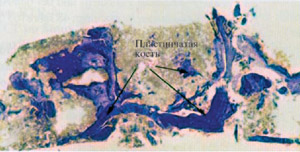 Рис. 5: Гистология через 5 месяцев после синуслифтинга
Рис. 5: Гистология через 5 месяцев после синуслифтинга
Надписи на рисунке: Пластинчатые кости
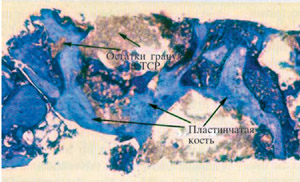 Рис. 6: Гистология через 6 месяцев после синуслифтинга (окраска голубым толуидином)
Надписи на рисунке: остатки гранул B-TCP, Пластинчатые кости
Наряду с гистологической оценкой препаратов, велось наблюдение за резорбцией гранул B-ТСР и образованием кости на основании контрольных рентгенограмм. Всего в группе пациентов после проведения синуслифтинга было установлено 72 имплантата, а в группе, где проводилось наращивание гребня альвеолярного отростка - 40 имплантатов.
РЕЗУЛЬТАТЫ
Гистологические исследования препаратов подтвердили остеоиндуктивные свойства материала. Одновременно происходила резорбция гранул B-ТСР. Гистологическое исследование образцов кости взятых из области внесения B-ТСР через 4 месяца, отчетливо показало интенсивное костнообразование между гранулами препарата (Рис.4). Гранулы B-ТСР по прошествии 6 месяцев были частично видны, и служили матрицей для образования кости. Одновременно остеообразование наблюдалось и внутри гранул B-ТСР . Это указывало на начинающуюся резорбцию материала.
Через 5 месяцев гранулы находились в состоянии прогрессирующей резорбции, в результате которой было создано дополнительное пространство для остеообразования (Рис.5). Через 7 месяцев на гистологических образцах можно было наблюдать изменение формы кости. Материал для костной регенерации к этому моменту значительно рассосался, в некоторых местах присутствовал только остатки гранул. (Рис.6). Было доказано, что B-ТСР полностью рассасывается в процесса созревания кости.
Рассасывание гранул можно было наблюдать также и при помощи рентгенологического исследования. Кроме того, наши контрольные рентгеновские исследования выявили, что после полного рассасывания вещества B-ТСР, вновь образованная кость в верхнечелюстном синусе в течение процесса ремодулирования опускается на более низкий уровень высоты. Затем, после установки имплантата и приложения нагрузки уровень высоты кости остается стабильным (Рис.7а.d).
С клинической точки зрения, успех костной регенерации оценивался на основании срока функционирования имплантатов. В группе, где проводилось наращивание гребня альвеолярного отростка, до сегодняшнего дня не утеряно ни одного имплантата, и таким образом, достигнут 100% эффект (Рис.8). Из 72 имплантатов установленных после синуслифтинга, было утеряно 4. Эффективности составила 94,44% (Рис.8).
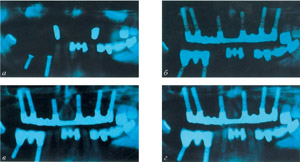
Рис.7: Панорамные контрольных рентгеновские снимки непосредственно после двухмоментного синуслифтинга (а), через 9 месяцев (б), через 33 месяца (с) и через 51 месяц (д).
Максимальный контрольный срок наблюдения за имплантатами, на сегодняшний день составляет 7 лет. Самый короткий срок использования имплантатов составляет 1,5 года (Рис.9). В 2001 году была установлено наибольшее количество имплантатов в группе пациентов после синуслифтинга. Из них было потеряно 3 имплантата. Эффективность составила 92% . Имплантаты установленные в период с 1999 и 2000гг. после 5 лет функционирования сохранены в 100% (Рис.9). Установлено , что все имплантанты были утеряны в течении первых двух лет после установки.
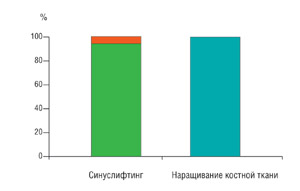 Рис. 8 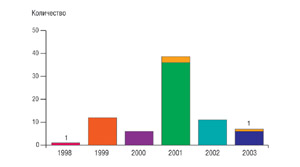 Рис. 9 Дискуссия
В случае потери имплантанта гистологические исследования показали, что прорастание соединительной ткани происходило в основном в области, где проводилось наращивание кости (Рис.10). Возможно, эта было вызвано непереносимостью между резорбируемой мембраной и гранулами B-ТСР. Мембрана рассасывается в результате реакции гидролиза, при этом высвобождаются молекулы с кислотными группами. В результате этого уровень рН снижается, что может ускорить процесс растворения B-ТСР и нарушить процесс регенерации.
В другом случае, речь шла о злостном курильщике. Гистологическое исследование, как и в предыдущем случае, показало, что прорастание соединительной ткани происходило в основном в области, где проводилось наращивание кости (Рис.11). В этой клинической ситуации к смеси крови и гранул B-ТСР была добавлена тромбоцитарная масса. Возможно, комбинированное воздействие этих двух факторов вызвало интенсивное прорастание соединительнотканного эпителия и в конечном итоге потерю имплантанта.
В двух других случаях, мы не получили логичного объяснения потери имплантанта. Так, например, в одном случае, после двустороннего синуслифтинга было установлено 4 имплантата. В области 26 один имплантат был потерян, хотя соседний имплантат в области 25 и оба имплантанта на противоположной стороне, до сих пор стабильно интегрированы.
Если мы будем рассматривать процент эффективности в группе пациентов после синуслифтинга и в группе пациентов, где проводилось увеличение альвеолярного гребля, то значения соотносятся с известными литературными данными.
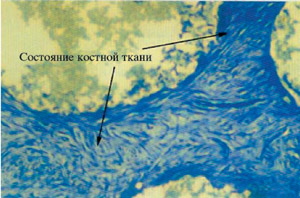 Рис. 10 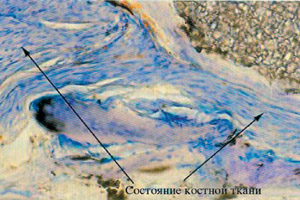 Рис. 11
ВЫВОД
Каждодневное клиническое использование B-ТСР подтвердило заявленные свойства материала. Гистологические исследования и контрольные рентгеновские снимки подтверждают резорбцию материала и интенсивное остеообразование.
Анализ гистологических препаратов показал, что гранулы B-ТСР не нарушали процесс образования кости. Одновременно было показано, что имплантаты надежно и стабильно интегрируются в области, где была проведена костная подсадка.
При двухэтапном синуслифтинге идеальный срок для установки имплантатов составляет 4,5 месяца. Не было замечено ни возрастной, ни половой зависимости в отношении сроков восстановления кости.
Гранулы B-ТСР представляют собой готовый остеотропный препарат, при использовании которого, не требуется применение аутокости и тромбоцитарной массы.
Список использованной литературы
1. Rueger J. M. (1996). Knochcncrsatzmitiel. Slate of Ihc art und: Wohin
gehen wir? Unfallchirurg 99: 228-236.
2. Tadic D., Epplc M. (2003). A thorough physico-chemical
characterisation of 14 calcium-phosphate-bascd bone substitution nuttcrials
in comparison to natural bone. Biomatcrials. 25: 987-994.
3. Wenz В. (2004). Die Prognose gibt den Ausschlag. Dent. Implantol.
8: 492-505.
4. Metsger D. S. et al. (1982). Tricalcium phosphate ceramic-a
resorbable bone implant: review and current status. J. Am. Dent. Assoc.
105: 1035-1038.
5. McAndrew M. P. et al. (1988). Tricalcium phosphate as a bone graft
substitute in trauma: preliminary report. J. Orthop. Trauma. 2: 333-339.
6. Husson J. L. et al. (2001). Les ceramiques en phosphate de calcium
sont elles une alternative aux grerfe cortico-spongieu- ses vertebralcs
poslero-laterales? [Use of calcium phosphate ceramics in posterolateral
vertebral fusion.| Rachis. 13: 223-228.
7. Levin M. P. et al. (1975). A comparison of iliac marrow and biodegradable
ceramic in pcriodontal defects. J. Biomed Mater. Res. 9: 183-195.
8. Mathai J. K. et al. (1989). Tricalcium phosphate ceramic as immediate
root implants for the maintenance of alveolar bone in partially edentulous
mandibuiar jaws. A clinical study. Aust. Dent. J. 34: 421-426.
9. Palti A., Hoch T. (2002). A concept for the treatment of various dental
bone defects. Implant. Dentistry. 11: 73-78.
10. Zerbo I. K. et al. (2004). Hislomorphometry of human sinus floor
augmentation using porous ii-tricalcium phosphate: a pro spective study.
Clin. Oral Implant. Res. 15: 724-732.
11. Cameron H. I. et al. (1977). Evaluation of biodegradable ceramic.
J. Biomed Mater. Res. 11: 179-186.
12. Saffar J. L. et al. (1990). Bone fonnation in lricalcium phospha tefilled
periodontal intrabony lesions. Hislological observations in humans.
J. Periodontol. 61: 209-216.
13. Trisi P. et al. (2003). Histologic effect of purephase beta-trical- cium
phosphate on bone regeneration in human artificial jawbo ne defects. The
International Journal of Pcriodonlics & Restora tive Dentistry. 23: 3-11.
14. Merten H. A. et al. (2 (100). Histomorphologischc Untersuchun- gen
zum Resorplionsverhalten phasenreiner b-TCP-Kerainiken im Tibiadefekt
des adulten Minipigs. [Hisiomorphological rese arch of Uic rcsorplion
behavior of pure-phase b-TCP ceramics in the tibial defect of an adult
minipig.] Osteosynthese International. 8: 107-110.
15. Artzi Z. et al. (2004). Biomaterial resorption rate and healing site
morphology of inorganic bovine bone and beta-tricalcium phosphate
in canine: a 24-month longitudinal histologic study and mor-phometric
analysis. Int. J. Oral. Maxillofac Implants. 19: 357-368.
16. Zerbo I. R. et al. (2001). Histology of human alveolar bone
regeneration with a porous tricalcium phosphate. A report of two cases.
Clin. Oral. Implants. Res. 12:379-384.
17. Wiltfang J. et al. (2003). Sinus floor augmentation with betatricalciumphosphate
(beta-TCP): does plateletrich plasma promote
its osseous integration and degradation? Clin. Oral. Implants. Res.
14: 213-218.
18. Kovacs K. et al. (2005). Hislomorphometric and densitometric
evaluation of the effects of plateletrich plasma on the remodeling of betatricalcium
phosphate in beagle dogs. J. Craniofac. Surg. 16: 150-154.
19. Del Fabbro M. et al. (2004). Systematic review of survival rates
for implants placed in the grafted maxillary sinus. Int. J. Periodontics
Restorative Dent. 24: 565-577.

|



